27 noviembre 2006
26 noviembre 2006
Anestesia para cirugía laparoscópica
El desarrollo de la cirugía mínimamente invasiva ha revolucionado los procedimientos quirúrgicos y este proceso ha influenciado la práctica de la anestesiología. Las ventajas de la laparoscopía incluyen la reducción global de las complicaciones, disminución de los tiempos de internación y un rápido retorno a las actividades diarias. Su éxito en pacientes sanos ha llevado a la introducción de gran número de procedimientos endoscópicos en pacientes de mayor edad y más enfermos, como así también en embarazadas y pacientes pediátricos. Los procedimientos laparoscópicos que tienen una aceptación creciente incluyen, adrenalectomía para feocromocitomas, la fundoplicatura de Nissen para los trastornos de reflujo gastroesofágico, bypass gástrico para la obesidad, y la nefrectomía (radical o del donante). Además, un número creciente de estos procedimientos se realizan como cirugías ambulatorias. A pesar de sus potenciales ventajas los procedimientos laparoscópicos están asociados con cambios fisiológicos, lo cual representa muchos desafíos para el anestesiólogo. Además, estos procedimientos están asociados con potenciales complicaciones que ponen en peligro la vida de los pacientes, que normalmente no encontramos en los procedimientos quirúrgicos abiertos. Por lo tanto, existe la necesidad de modificar la técnica anestésica para poder realizar en forma segura este novel procedimiento quirúrgico. Con el mejoramiento en la tecnología y el crecimiento de la experiencia quirúrgica, cada vez se realizarán más procedimientos laparoscópicos extensos y prolongados en un amplio rango de pacientes. La modificación de la técnica anestésica y la prevención de las complicaciones postoperatorias comunes incluidas el dolor, náuseas y vómitos, usando un enfoque multimodal, debería permitir una recuperación rápida. Aunque la laparoscopía brinda beneficios significativos, una total comprensión de los cambios cardiopulmonares asociados y de las potenciales complicaciones, es necesaria para mantener la seguridad del paciente.
Para leer el artículo completo clikear aqui.
Autor:
Girish P. Joshi MB BS MD FFARCSI
Departamento de Anestesiología y tratamiento del dolor
Universidad de Texas
Centro Médico de Southwestern, Dallas,Texas, EE.UU.
Canadian Journal of Anesthesia 2002;49:R1-R5
Fuente: Revista de la Sociedad Platense de Anestesiología
www.spa.org.ar
25 noviembre 2006
Videos sobre técnicas de intubación
Departamento de Anestesiología de la Universidad de Florida
Los videos tardan en cargarse, con un poco de paciencia bajan y se ven perfectamente. Sumamente recomendados.
| Video Library |
AIRTRAQ Videos
AIRTRAQ Preparation
Using the AIRTRAQ Camera
AIRTRAQ Case 1 Without Camera
AIRTRAQ Case 2
AIRTRAQ Case 3
AIRTRAQ Case 4 Fogging due to late activation of light and lens heater
Bullard Laryngoscope Videos
Direct Laryngoscopy (DL) Videos
Fiber Optic Bronchoscopy (FOB) Videos
FOB Case 1
FOB Case 2
FOB Case 3
FOB Case 4 Due to a head clamp, intubation by other means would have been difficult
Upsher Larynogoscope Videos
22 noviembre 2006
Bloqueo del plexo braquial
El plexo braquial puede ser bloqueado en 5 niveles diferentes: interescalénico, supraclavicular, infraclavicular, axilar y humeral medio. El plexo braquial pasa entre el músculo escaleno anterior y el músculo escaleno medio y allí es abordable en el bloqueo interescalénico. Más abajo antes de la clavícula por fuera de la yugular externa es abordable en el bloqueo supraclavicular. Si lo abordamos en el surco delto-pectoral por debajo de la clavícula y con la aguja en dirección a la apófisis mastoides ipsilateral hablamos de bloqueo infraclavicular. Cuando abordamos el plexo a nivel de la axilar hablamos de bloqueo axilar. Existe un abordaje aún más bajo a nivel humeral medio (mid-humeral block). La arteria axilar y los nervios están envueltos en una vaina aponeurótica (que va desde la fascia cervical profunda hasta la axila) que permite la realización de los llamados bloqueos perivasculares. El latido arterial es la referencia a buscar y trabajamos con la aguja cercano a él (ello ocurre a nivel axilar y en el bloqueo 3-en-1 de la extremidad inferior). Antes de llegar a la axila el plexo se divide en varios nervios: musculocutáneo, mediano, cubital, radial, axilar y circunflejo. Dentro de la vaina aponeurótica existen septos que determinan mayor o menor efecto de los AL una vez inyectados dentro de ella. A pesar de ello se trabaja con inyección única (algunos colegas prefieren identificar cada uno de los nervios por neuroestimulación). Cuando utilizamos el neuroestimulador obtenemos una serie de respuestas motoras según el nervio estimulado.
1. Nervio circunflejo o axilar: contracciones deltoides (abducción brazo)
2. Nervio musculocutáneo: flexión del codo en supinación
3. Nervio mediano: flexión y abducción radial de la muñeca, pronación del antebrazo (flexiona la falange proximal del pulgar), flexión y adducción del pulgar con flexión dedos I-III interfalángica distal)
4. Nervio radial: extensión del codo, extensión y abducción radial de la muñeca, extensión y flexión dorsal de la mano, extensión de los dedos
5. Nervio cubital: flexión y abducción de la muñeca en dirección cubital y flexión de los dedos IV-V
Bloqueo axilar
El abordaje en esta zona implica que del plexo ya se han formado los nervios periféricos del brazo. El nervio axilar o circunflejo y el musculocutáneo (que contiene las fibras del nervio cutáneo lateral del antebrazo o accesorio del braquial cutáneo interno) emergen del plexo por encima del nivel de abordaje. Se coloca el brazo a bloquear en abducción no mayor de 90º con flexión del antebrazo y el paciente en decúbito supino. Por detrás del surco bicipital medial a nivel de un 2 cm distales a la línea axilar se detecta el latido de la arteria axilar. El lugar de punción se ubica ligeramente por encima de la arteria. Se practica un habón cutáneo de mepivacaína o lidocaína al 1% y se introduce la aguja de neuroestimulación 22G, 15º y 50 mm paralelamente a la artera axilar y a unos 30º de inclinación respecto al plano de la mesa de soporte del brazo. Se obtienen contracciones en el área del mediano o mejor aún el radial. Se busca el umbral de neuroestimulación a 0,2-0,3 mA y se inyectan 40 ml de ropivacaína al 0,5% o de mepivacaína al 1%. Si la estimulación es del nervio musculocutáneo no debemos inyectar ya que a este nivel corre al lado del músculo coracobraquial pero por fuera de la vaina, por lo que el bloqueo fallaría. El bloqueo se puede realizar sin neuroestimulacion con o sin parestesia, y empleando una aguja de epidural de Hustead o Tuohy para cateterizar la vaina en caso de rehabilitación o analgesia postoperatoria mantenida en el tiempo, o un equipo específico de cateterización de plexo (aguja de neuroestimulación con introductor de teflon). La cateterización no es simple y a veces se percibe resistencia al paso del catéter. Hay que aspirar siempre antes de inyectar tanto a través de aguja como de catéter. Con esta técnica (aguja de Husmead) hemos descrito bloqueos a largo plazo utilizando sistemas portales. Hay que recordar que hay que bloquear el nervio intercostobraquial y el accesorio del braquial cutáneo interno con un pequeño rodete de anestésico local en la zona de punción, en la cara interna del brazo, para evitar el dolor del torniquete si éste se ha de usar.


Video
INDICACIONES:
Cirugía del codo, antebrazo y brazo.
CONTRAINDICACIONES:
No hay contraindicaciones específicas, salvo la negativa del paciente, la infección de la zona o la alergia a anestésicos locales.
COMPLICACIONES:
Inyección intravascular inadvertida (aspirar siempre antes de inyectar), hematoma de la vaina.
Autores:
Dr. Jose L. Aguilar,
Dr. X. Sala-Blanch,
Dr. M.A. Mendiola
Asociación Andaluza-Extremeña de Anestesiología
19 noviembre 2006
Reversión de la relajación neuromuscular y medios de monitoreo
Los métodos instrumentales son los más apropiados para monitorizar la función neuromuscular afectada durante la anestesia por los relajantes musculares de acción periférica y, accesoriamente, por los demás fármacos empleados en aquélla. Con medios relativamente simples (sólo un estimulador portátil), puede hacerse un uso más adecuado de los relajantes musculares, brindando mayor margen de seguridad en el postoperatorio inmediato. Si bien ello es evidente en el manejo de los relajantes no despolarizantes (RMND) clásicos o la succinilcolina (SCH), lo es más aun con los nuevos agentes de duración corta o intermedia (vecuronio, rocuronio, mivacurio, rapacuronio, atracurio y cis-atracurio), ya que permiten indicar el momento justo de la reinyección sin tener en cuenta apreciaciones del cirujano que resulten desacertadas y que lleven a la acumulación indebida de efectos. Con estos nuevos agentes, el monitoreo instrumental también es imprescindible cuando termina el acto anestésico, para poder decidir si se administra o no neostigmina con el fin de revertir los efectos residuales del relajante, y para tener una estimación de la dosis de anticolinesterasa a inyectar.
En presencia de estados patológicos o fármacos que alteren la normal respuesta a los relajantes (por ejemplo: miastenia gravis, síndrome miasténico, miopatía tirotóxica, terapéutica con propanolol u otro tipo de medicación activa al respecto), el monitoreo permite un manejo más ajustado y preciso de los RMND en el intraoperatorio, mayor control de la reversión y un elemento diagnóstico y pronóstico en el postoperatorio inmediato. La detección de una recuperación adecuada permite, a su vez, hacer un diagnóstico diferencial con respecto a depresiones postanestésicas originadas por otros fármacos e implementar el tratamiento específico.
Con el objeto de lograr un aprovechamiento integral del método, deben considerarse sus elementos constitutivos y la interpretación correcta de las respuestas a la neuroestimulación observadas. Para ello, es necesario un breve recuerdo de las bases fisiológicas que permitan comprender esta metodología de monitoreo, una de cuyas modalidades menos complejas es accesible para cualquier anestesiólogo. Existen varios métodos de monitoreo de la función neuromuscular durante la anestesia, desde la simple observación o palpación de las respuestas a la neuroestimulación, hasta registros sofisticados de la actividad muscular resultante. La respuesta igual a la estimulación de doble ráfaga tetánica (DBS) es el mejor medio disponible, actualmente, para asegurar adecuado recobro de la fuerza muscular en ausencia de registro de las respuestas musculares; mientras que, con registro, el TOF superior al 80% es lo definitivo, y no puede ser sustituido metodológicamente por las diversas pruebas clínicas propuestas, que son todas de menor sensibilidad y especificidad. De los métodos con registro, el más práctico para el monitoreo rutinario es la acelerometría isotónica.
La incompleta o incorrecta reversión del efecto de los relajantes musculares es causa de potenciales complicaciones en el postoperatorio inmediato, algunas de las cuales se pueden extender en el tiempo. Si bien inicialmente es afectado el aparato respiratorio, se pueden derivar daños a otros órganos. Un bloqueo correctamente revertido puede, en presencia de niveles plasmáticos altos de relajante, volver a manifestarse en sala de recuperación, aunque su intensidad sea algo menor.
La responsabilidad del pronóstico, el reconocimiento y el tratamiento de la parálisis residual por relajantes musculares es tanto del anestesiólogo actuante como del profesional a cargo de la sala de recuperación.
Autor:
Dr. Patricio J. Kelly
Profesor Asociado, Cátedra de Anestesiología, Facultad de Medicina, Universidad del Salvador. Consultor del Servicio de Anestesiología del Hospital Británico, Perdriel 74, (1280) Buenos Aires. Dirección Postal: Servicio de Anestesiología del Hospital Británico, Perdriel 74, (1280) Buenos Aires.
Vol. 58 – Num. 4 – Julio-Agosto de 2000
Anestesia en lugares fuera del área quirúrgica
El requerimiento del anestesiólogo fuera del área quirúrgica está en constante aumento. Es una actividad que engloba los diferentes grados de sedación, anestesia y vigilancia utilizados en la práctica habitual, pero con características diferentes a las aplicadas al paciente quirúrgico. Un entorno de trabajo “hostil” suele ser la norma. En estos casos debe procurarse el nivel de sedación-anestesia más ligero que permita el procedimiento y utilizando el menor número de fármacos posible, pero pensando que una sedación o analgesia inapropiada puede resultar en profundo disconfort o lesión para el paciente (por falta de cooperación o respuesta excesiva al estrés). Al generalizarse los procedimientos de sedación-anestesia en los “lugares alejados del quirófano”, se empezaron a reportar complicaciones graves con resultado de muerte o discapacidad grave del paciente, la mayoría de las ocasiones por problemas respiratorios y debidas muchas veces a una falta de vigilancia adecuada o una mala indicación de la sedación. Por ello, hay que tener presente que aunque cada área de trabajo va a tener unas peculiaridades que hay que conocer y que nos condicionarán la técnica de anestesia o sedación a emplear y los cuidados especiales en cada caso, el seguimiento preciso de una serie de recomendaciones para la monitorización y manejo de los pacientes para este tipo de asistencia anestésica, es fundamental para disminuir la posible morbi-mortalidad asociada, debiendo ser el nivel de vigilancia del paciente igual al que exigimos cuando trabajamos en el quirófano. El mismo principio es aplicable a los cuidados postanestésicos y criterios de alta.
RECOMENDACIONES GENERALES
El mínimo exigible imprescindible en un área en la que se vaya a realizar cualquier procedimiento anestésico es contar con:
-Sistema capaz de proporcionar oxígeno a presión a una concentración mínima del 90% y débito de 15 L/min.
-Fuente de succión (portátil o de pared).
-Equipamiento para monitorizar según todos los estándares mínimos (ECG, presión no invasiva, pulsioximetría).
-Fármacos y material necesarios para el manejo de la vía aérea y la renimacióncardiopulmonar (ambú, sondas, tubos endotraqueales, laringoscopio...).
Si el área en cuestión no dispone de estos mínimos, el equipamiento debe ser trasladado antes de proceder a cualquier tipo de sedación (aunque se haya previsto como superficial, pues ésta puede fallar o complicarse). Deberá asimismo tenerse previsto un lugar de observación o despertar para la vigilancia del paciente tras el procedimiento.
Elección de la técnica anestésica
En los casos en que la inmovilidad total no sea un imperativo, una sedación superficial puede ser suficiente (incluso en niños pequeños) para lograr un cierto grado de ansiolisis, pudiendo combinarse con infiltraciones de un anestésico local en ciertas circunstancias (vg, reparación de desgarros cutáneos, punciones medulares...). Para técnicas más dolorosas (angiografía, cateterismo cardíaco, reducción de fracturas...) o en las que la inmovilidad absoluta es necesaria durante un cierto periodo (métodos de diagnóstico por la imagen, radioterapia, exploraciones oftalmológicas...), se requerirá una sedación profunda con o sin opiodes. En general, éstos últimos deben reservarse únicamente para los procedimientos dolorosos, no debiendo emplearse simplemente en sedaciones para técnicas no invasivas (como la práctica de un escáner o una resonancia magnética). Los pacientes en los que la hipoventilación constituye un peligro especialmente importante (vg, aumento de la presión intracraneal por tumores), los de alto riesgo de presentar complicaciones cardiorrespiratorias (niños prematuros, cardiopatías avanzadas, encefalopatías graves, neumopatías con retención de CO2...) o aquellos en los que la probabilidad de obstrucción de la vía respiratoria superior está aumentada (malformaciones faciales, niños con grandes adenoides o amígdalas, obesidad...), no son buenos candidatos a una sedación profunda, sobre todo si la vía aérea no puede controlarse de manera contínua (vg, durante una exploración radiológica). En estos casos es mandatorio el control de la función ventilatoria, por lo que se debe realizar como máximo una sedación suave dosificando cuidadosamente los fármacos, precisándose así una cierta colaboración del paciente, u optar de entrada por una anestesia general con intubación orotraqueal (IOT); una opción es emplear mascarilla laríngea (en el caso de los niños, si se tiene la suficiente experiencia). La anestesia general con IOT también se elegirá cuando la técnica de sedación falla o no es suficiente, y cuando deba protegerse la vía aérea (vg, procedimientos urgentes en pacientes con estómago lleno). Los fármacos sedantes-anestésicos pueden administrarse vía oral, rectal, nasal, intramuscular o endovenosa, siendo ésta última la más predictible y segura para controlar el grado y duración de la sedación y es por ello la más indicada para la mayoría de las ocasiones. De todas maneras, no existe una droga o vía de administración de elección, siendo la más adecuada aquella que mejor se adapta a cada situación o que mejor conoce y maneja el anestesiólogo. Siempre deben administrarse suplementos de oxígeno sea cual sea la profundidad de la sedación, pues el paciente puede caer con facilidad e inadvertidamente desde un estado de sedación superficial a uno profundo con hipoventilación, obstrucción respiratoria, apnea y hasta paro cardiorrespiratorio por absorción lenta o tardía de los fármacos administrados, falta de estímulo externo o diferente respuesta individual, difícil de prever.
Monitorización
En cualquier paciente sedado, es obligado como mínimo el control contínuo de la función ventilatoria con pulsioximetría y vigilancia del ritmo respiratorio, siendo deseable el control de la presión arterial y ritmo cardíaco por ECG (imprescindible en los casos de sedación profunda o anestesia general). El que un paciente mantenga la consciencia o sea fácilmente despertable, no garantiza la preservación de los reflejos protectores ni implica que no pueda estar hipóxico o hipercápnico. A continuación, se describen algunos de los procedimientos más específicos de la asistencia fuera de los quirófanos, con unas peculiaridades que hay que conocer para la administración de sedaciones-anestesias seguras y un adecuado cuidado del paciente.
Para continuar leyendo el articulo completo clikear aquí.
Dra. L. Salvador
Servicio de Anestesiología, Reanimación y Terapeútica del dolor
Hospital Clínic i Provincial. Barcelona.
Fuente: http://www.academia.cat/
18 noviembre 2006
Traumatismo Torácico y Anestesia
En la población general de Europa y Estados Unidos los accidentes constituyen la cuarta causa de muerte y la primera en menores de 34 años. De los pacientes admitidos a causa de traumatismos un tercio presenta lesiones torácicas, siendo los accidentes de tránsito la principal fuente de producción de éstos . Al analizar diferentes factores se ha encontrado asociación con la ingesta de alcohol y la conducción desaprensiva o de noche, la conducción a alta velocidad tiene relación con la severidad y morbimortalidad del traumatismo. Las lesiones torácicas están presenten casi en la mitad de los choferes que conducen sin cinturón de seguridad al momento del accidente. Otro de los aspectos importantes del traumatismo torácico es su gravedad. En términos globales, es responsable de un cuarto de las muertes en los politraumatizados y contribuye en otro cuarto de los fallecimientos. Lo dramático del caso es que muchas de las causas son potencialmente tratables: taponamiento cardíaco, neumotórax a tensión, obstrucción de la vía aérea. Al momento de ser hospitalizados, un cuarto de los pacientes es de gravedad y otro cuarto se agrava después. Se trata en general de pacientes jóvenes, es decir, población productiva con predominio del sexo masculino. Tiene una alta asociación (60 - 70%) a lesiones de otra localización, las que frecuentemente marcan el pronóstico y es por ello que habitualmente el cuadro clínico será un politraumatismo dentro del cual se debe tratar el traumatismo torácico.
Manejo Inicial
Las primeras medidas se destinan a evaluar el riesgo vital a que está sometido el paciente, determinando si la causa de esto es de tratamiento quirúrgico o no y a estabilizar las funciones ventilatoria y circulatoria. En esta fase el anestesista puede ser requerido antes de la llegada del paciente a pabellón. Se debe considerar la posibilidad de obstrucción de la vía aérea superior por cuerpo extraño, el compromiso dado por un traumatismo máxilo-facial o encéfalo craneano o bien la dilatación aguda del estómago. Debe buscarse la causa del shock, habitualmente hipovolémico, en una lesión intratorácica o de otra localización. Si el shock se acompaña de una presión venosa central elevada, se puede deber a:
- Neumotórax
- Hemotórax masivo
- Enfisema mediastínico importante
- Contusión miocárdica
- Taponamiento cardíaco
Anestesia
En términos generales sólo un 15% de los pacientes con traumatismo torácico requiere cirugía. La toracotomía de salvataje en pacientes con traumatismo cerrado está indicada sólo cuando están ausentes los signos vitales. Por lo ya descrito, la condición del paciente en general es bastante diferente de aquellos pacientes programados para una cirugía torácica electiva. Además, la técnica anestésica para este tipo de pacientes debe comprender todas las medidas consecuentes con el manejo del paciente hipovolémico o en shock. La evaluación de estos pacientes debe ser lo más completa que la situación permita. Siguiendo a los exámenes de rutina (hemograma, uremia, glicemia, protrombina) se debe contar con el estudio radiológico de tórax que es indispensable para tener un índice de las probables complicaciones, además de evaluar alguna patología pulmonar previa aún cuando la presencia de complicaciones intratorácicas puede dificultar su interpretación. En urgencia los estudios de función pulmonar se restringen al análisis de los gases en sangre. Los otros medios de diagnóstico se emplean de acuerdo a la necesidad del caso clínico en cuestión. La tomografía computada de tórax presenta una gran sensibilidad en la pesquisa de lesiones así como en la detección de hemotórax y neumotórax mínimo que la radiografía es incapaz de diagnosticar. La broncoscopía tiene su lugar en la evaluación de la integridad de la vía aérea y en la limpieza de secreciones o elementos sólidos productos de aspiración de contenido gástrico o elementos presentes en la boca al momento del accidente. La ecocardiografía transesofágica representa un elemento muy útil en la evaluación de estos pacientes ya que aparte de tratarse de un método no invasivo y rápido, es capaz de entregar información sobre la condición hemodinámica (precarga y contractilidad), dar índices de contusión miocárdica y evaluar la integridad de la aorta.
Monitoreo
Dada la urgencia de esta cirugía y de emergencia en determinadas situaciones como las heridas cardíacas por arma blanca, frecuentemente se está obligado al inicio rápido de la anestesia, no siendo posible la instalación de monitoreo sofisticado o invasivo, ya que la realización de procedimientos antes de la inducción sólo produce demora en la corrección quirúrgica y muchas veces no son necesarios después de ésta. Debe instalarse un electrocardioscopio y un aparato automático para medir la presión arterial (método oscilométrico). Aparte de esto debemos aprovechar al máximo lo que la clínica nos entrega: coloración de piel (palidez, cianosis), llene capilar, color de la sangre en el campo operatorio. La instalación de una vía central siempre es posible una vez que la cirugía ha comenzado, utilizándose principalmente para la administración de drogas vasoactivas ya que su utilidad como evaluación de la volemia en esta cirugía es más que discutible. La indicación de un catéter de arteria pulmonar no es materia de discusión, su instalación en una situación de urgencia debe ser sopesada en su relación costo-beneficio. En este sentido la presión arterial invasiva da un índice más fiable de la precarga ventricular izquierda que la PVC o el capilar pulmonar con el paciente en decúbito lateral. A causa de las múltiples variables puestas en juego en esta cirugía es muy posible la producción de episodios de hipoxemia y/o hipoventilación por lo cual el oxímetro de pulso y el capnógrafo son recomendados toda vez que ellos estén disponibles en el pabellón. Debe instalarse una sonda vesical y un método de medición de la temperatura central, como es de indicación en todo shock hipovolémico.
Técnica
El lugar de la anestesia regional en urgencia está limitado a una técnica de analgesia post-operatoria o en lesiones parietales extensas que por dolor afectan la mecánica ventilatoria y el mecanismo de la tos; resulta particularmente útil en los pacientes añosos con lesiones esqueléticas. Raramente se puede realizar una técnica mixta con anestesia general, en el contexto de la cirugía torácica de urgencia. Estos pacientes deben ser tratados como portadores de estómago lleno, utilizando todas las medidas descritas en la inducción de la anestesia. Se debe instalar un drenaje torácico cada vez que exista un hemo-neumotórax antes o durante la inducción anestésica, en caso que ese hemitórax no vaya a ser abordado quirúrgicamente. Si el estado hemodinámico es inestable, pentotal y propofol deberían evitarse. Como alternativas válidas de inducción están la ketamina, el etomidato y los narcóticos. En caso de neurotrauma concomitante están más indicados pentotal, propofol y etomidato; la ketamina puede ser usada si el aumento de la presión intracraneana es compensado con la mantención o aumento de la presión de perfusión. La mantención de la anestesia generalmente se realiza con gases halogenados, los que presentan varias ventajas: inhiben la irritabilidad de la vía aérea siendo capaces de revertir la broncoconstricción, a diferencia de fentanyl tienen una eliminación rápida lo que permite evaluar la condición ventilatoria del paciente en el postoperatorio inmediato, dan una razonable estabilidad cardiovascular aún considerando pacientes cardiópatas o hipertensos.
Autor: Dr. Mauricio Ramos
15 noviembre 2006
Ayuno Prequirúrgico
Por años los pacientes han sufrido la orden preoperatoria de «nada por boca después de medianoche», siendo en realidad aplicada a partir de 1960 y, ampliamente aceptada mientras no fuese uno quien sufriese el ayuno. Ya, en el año 1883 el cirujano Lister (1827-1912) recomendaba que no hubiese materia sólida pero sí ingesta líquida dos horas previas a la cirugía y, hasta el año 1960 la mayoría de los libros recomendaban seis horas de ayuno para los sólidos y dos a tres horas para los líquidos. A principios de la década del 90 comienzan a aparecer los primeros trabajos científicos con la inquietud del cambio. Un consenso realizado en el año 1997, entre los anestesiólogos del Hospital Nacional de Pediatría Juan P. Garraham, permitió aplicar las nuevas pautas de ayuno previa a la publicación de la guías sobre el mismo de la Sociedad Americana de Anestesiología (ASA). En el año 1999 la ASA publicó unas recomendaciones en forma muy completa y actualizada, elaboradas por un grupo de 10 expertos : “Ayuno preoperatorio y el uso de agentes farmacológicos para reducir el riesgo de aspiración pulmonar en pacientes sanos sometidos a procedimientos programados». El fin de las misma fue ordenar el tiempo de ayuno requerido y la indicación de la medicación preventiva de neumonitis por aspiración de liquido gástrico, que variaba entre los distintos servicios de anestesia norteamericanos como canadienses. Lamentablemente aún hoy en nuestro país muchos pacientes sufren las innecesarias consecuencias de un ayuno prolongado y nos deberíamos preguntar: ¿es el miedo a una bronco aspiración de líquido gástrico, la falta de instrumentación de una visita preanestésica o la no divulgación de las mismas lo que ha impedido su adecuada implementación?. Este artículo tiene como principal objetivo hacer llegar los conceptos más importantes de esta guía y ofrecer las conclusiones fisiopatológicas más relevantes sobre la evacuación gástrica y el ayuno. Para leer el artículo completo clikear aqui.
Autor: Dr. Guillermo Eskenazi
Fuente: Sociedad Platense de Anestesiología
El Combitubo
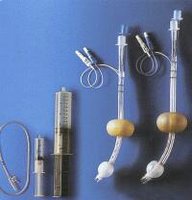

Aunque la intubación endotraqueal sigue siendo el método ideal para el manejo de la vía aérea, principalmente en los pacientes que se consideran con estómago lleno pues los protege frente al riesgo de broncoaspiración, requiere adecuado entrenamiento y practica constante, paralela a esta consideración existe la posibilidad de pacientes que presenten dificultad para llevarla a cabo exitosamente. En el pasado, eran pocas las opciones para permeabilizar la vía aérea de una manera tan eficiente como la intubación endotraqueal. Recientemente se han diseñado otros dispositivos y algunos de ellos han logrado resultados exitosos y se han convertido en alternativas importantes pues pueden proveer adecuada ventilación y oxigenación . sin la pericia técnica que requiere el uso de los tubos, endotraqueales. De estos dispositivos los más importantes reconocidos en nuestro medio son la laringea y el combitubo. En el presente artículo se hará una descripción detallada del tubo bilumen traqueo-esófágico Combítubo, R, iniciando por el recorrido de los dispositivos esofágicos que lo antecedieron, sus características, indicaciones, ventajas, desventajas, y contraindicaciones.
1. DESARROLLO DE DISPOSITIVOS ESOFÁGICOS
Varios instrumentos esofágicos para el manejo de la vía aérea han sido diseñados intentando encontrar uno que logre proveer una adecuada ventilación sin el riesgo de broncoaspiración, principalmente para usar durante la reanimación cardiopulmonar A través del tiempo se han hecho modificaciones a medida que se han encontrado desventajas, a continuación se describirán algunos.
1. El obturador esofágico
Don Michael en 1968 diseñó un instrumento para proveer ventilación sin el riesgo de la broncoaspiración, fue el llamado dispositivo de vía aérea boca-pulmón y fue el primero de los dispositivos esofágicos. Consistía en un tubo flexible, y varios orificios en la parte media. En la porción proximal presentaba una adaptación que formaba un sello en la boca. En la porción distal era ciega y tenía un balón. El tubo entra al esófago, al inflar el balón se impide el paso de aire al estómago. El aire es suministrado por la boca del reanimador a través del tubo y pasa hacia la hipofaringe por los orificios. La nariz debía ser ocluida para que no se presentara escape y permitiera el paso hacia la glotis y de allí hacia la tráquea y los pulmones. Posteriormente Don Michael y Gordon crearon el obturador esofágico. Es un tubo semirígido de 34 cm con un balón distal y 16 orificios en la parte proximal. Una máscara es conectada en la punta proximal para formar un sello en la boca y la nariz. Cuando el obturador está en su sitio, el tubo queda en el esófago, el balón inflado se ubica bajo la bifurcación traqueal, los orificios se localizan en la hipofaringe y la máscara queda presionando la cara del paciente. Así, con una bolsa de ventilación el aire es forzado a pasar hacia los pulmones.El obturador protege al paciente contra la regurgitación y varios trabajos han demostrad o que es un medio efectivo para la ventilación de pacientes en casos de emergencia. Sin embargo, se han evidenciado varias desventajas:
1. Puede ser difícil obtener buen sello de la cara con la máscara. Principalmente en pacientes edéntulos o barbados y por lo tanto puede haber escape de aire.
2. En 8 a 20% de los casos el tubo queda en tráquea, causando obstrucción completa de la vía aérea y distensión gástrico y los intentos de reposición son usualmente inefectivos.
3. Existe riesgo de ruptura esofágica, lo que es atribuible al trauma causado por su longitud, Insuflación exagerada del balón o presión ejercida cuando hay regurgitación masiva.
4. No permite la aspiración y descomprensión gástrica.
5. No protege la vía aérea frente a la aspiración de sangre o detritus del tracto respiratorio superior.
Por todas estas desventajas el obturador esofágico fue declarado no recomendable para reanimación cardiopulmonar por la Sociedad Americana del Corazón en 1992.
2. Tubo gástro-esofágico
Fue diseñado para superar los defectos del obturador, consta de un tubo semirígido adaptado a una máscara facial. El tubo tiene también balón distal, pero no los orificios faríngeos. La máscara facial presenta dos aberturas, la una comunica con el tubo que es abierto en su interior y permite el paso de una sonda para descomprimir el estómago, y la otra que tiene proximalmente un adaptador convencional de 1 5 mm a través de la cual se oxígena al paciente con una bolsa de ventilación. El aire es forzado hacia la tráquea debido a que no se permite su escape por boca o nariz por la máscara ni hacia el esófago por el balón esofágico.
3. Tubo faríngeo-traqueal
Representa un mejoramiento del obturador y el tubo gastro esofágico. Ha sido puesto para el uso clínico en EUA y Gran Bretaña. Consta de dos tubos uno largo y otro corto. El tubo largo corre dentro del corto y termina en un balón distal cuya función es impedir la salida de material gástrico hacia la vía aérea, queda ubicado en el esófago, a través de este se puede pasar una sonda para aspirar contenido gástrico. El tubo corto termina justo en la faringe, tiene un balón más grande proximal a la salida del otro. Este balón al ser inflado oblitera la hipofaringe. Ambos balones son inflados a través de una válvula única. La ventilación se lleva a cabo a través del tubo corto. Las ventajas sobre sus antecesores son que permite la aspiración de contenido gástrico, que es posible la ventilación cuando queda en tráquea y que no es necesaria la máscara facial para la ventilación. Antes de la ventilación se debe estar seguro de la ubicación del tubo, lo que se logra con la auscultación pulmonar y gástrica y/o la aspiración por ambos tubos. Hasta ahora no hay reportes de su uso en un gran número de pacientes. Se debe tener especial cuidado en pacientes con lesiones intraorales o faríngeas pues puede crear falsas rutas.
4. Tubo traqueo-esofágico
Este instrumento consta de una máscara facial con dos aberturas, la una unida a un adaptador de 15 mm y la otra a un tubo endotraqueal. Es insertado a ciegas o con ayuda de laringoscopio. Una vez es insertado se infla el balón distal del tubo y se ventila a través de él, si es confirmada la ventilación pulmonar, esta se continuara. Si el tubo queda en esófago, una bolsa de ventilación se adapta al conector de 15 mm y la ventilación se hace con la máscara.
2. EL COMBITUBO
Intentando sobrepasar las desventajas de los dispositivos esofágicos hasta ahora nombrados, se ha desarrollado el combitubo traqueo-esofágico (Kendal Sheridan Catheter Corp., Argyle, New-York, USA). Fue diseñado por Michael Frass, Reinhard Frenzer and Jonas Zahler en Viena, Austria. Se ha venido usando en Europa y EUA desde finales de 1980. Fue aprobado para su uso por la FDA en 1988-5.
1. Descripción
El combitubo es un dispositivo para intubación que combina las funciones de un obturador esofágico y un tubo endotraqueal. Es un tubo de plástico de doble luz y funciona cuando queda ubicado en esófago o en tráquea. La máscara de los otros dispositivos fue reemplazada por un balón elástico de látex orofaríngeo, que ajusta adecuadamente con la anatomía de la faringe y sella la cavidad oral y nasal. Se consigue en dos tamaños de 37 y 41 Fr. Como ya se mencionó presenta dos luces, la luz N' 1, llamada esofágica (proximal, azul, larga) tiene una abertura proximal y una terminación distal ciega, presenta ocho perforaciones que permitirán el paso del aire hacia la laringe. La luz No 2, llamada traqueal (distal, clara, corta) es abierta proximal y distalmente. Las luces están separadas por una pared. Proximalmente ambos tubos poseen adaptadores convencionales de 15 mm para conectar sistemas de ventilación. El balón orofaríngeo está colocado próximamente a las perforaciones faríngeas y es llenado por la válvula de color azul. Distalmente se presenta un balón de menor tamaño que es llenado por la válvula clara. A diferencia del tubo faringeo-traqueal, cada balón se infla por una válvula distinta, permitiendo así el ajuste individual. Dos marcas anulares de color negro indican la profundidad de la inserción. En el empaque distribuido por la fábrica, junto con el tubo se encuentran dos jeringas una de 140 ml y una de 20 ml, las cuales se utilizan para llenar los balones proximal y distal respectivamente. Así mismo trae una sonda para aspirar de 12 fr. para utilizar cuando está en esófago.
2. Técnica de inserción
Para su inserción el operador puede situarse detrás de la cabeza del paciente o frente a ella, la lengua y la mandíbula son traccionadas con los dedos pulgar e índice de la mano no dominante. Teniendo la cabeza en posición neutra, se introduce el tubo lubricado de manera suave pero firme en la concavidad anterior, y es desplazado hacia el interior con finos movimientos rotacionales hasta que las marcas anulares de color negro queden ubicadas entre los dientes o entre las encías en los edéntulos. En algunas ocasiones será necesario hacer laringoscopia para una adecuada colocación6. Tanto los creadores como la Compañia que lo distribuye recomiendan llenar el balón orofaríngeo con 100 ml, a través de la válvula No 1 (azul) y el distal con 15 ml por la válvula N' 2 (clara)'. Sin embargo, las investigaciones con este dispositivo demuestran que para evitar el escape de aire pueden bastar tan solo 48 a 72 mll. Cuando se presenta escape se agregan 50 ml de aire al balón. Algunos recomiendan no inflar el balón distal hasta no comprobar que el tubo esta en esófago por temor a la lesión de la mucosa traqueal o las cuerdas vocales. Cuando el balón proximal es inflado ocurre un pequeño desplazamiento del tubo hacia fuera del paciente, esto hace parte del proceso de acomodación y no necesita ser desplazado a la posición original. Si el dispositivo está bien ubicado, este balón queda entre la base de la lengua y el paladar blando, esto le sirve de fijación durante la ventilación y el transporte del paciente. Luego de la inserción a ciegas, el combitubo queda en posición esofágica en 96 a 98% de las veces. De todas maneras se aconseja hacer pruebas para verificar su ubicación. Debido a que el balón esofágico evita el escape de aire por nariz o boca y el distal su entrada hacia esófago, este es empujado a la glotis y de allí hacia la tráquea y pulmones. En esta posición se puede pasar una sonda de 12 fr. para aspirar el contenido gástrico, pero no permite la extracción de secreciones de la vía aérea. Cuando el combitubo queda en posición traqueal, funciona como un tubo endotraqucal convencional.
2. 1. Verificación de la ubicación
Según sus creadores, la ventilación se debe iniciar por el tubo No 1 (azul) lo que lleva aire por la vía proximal hacia la faringe a través de los orificios faríngeos. Si se ausculta murmullo vesicular bilateral y no hay distensión gástrica el tubo quedó esofágico y por lo tanto se debe continuar la ventilación por la misma vía. Cuando por el contrario, no se ausculta murmullo vesicular y existe distensión gástrica, el combitubo esta en traquea. Sin retirar el tubo, la ventilación se hará por la vía distal (clara). En esta posición el balón orofaríngeo se desinfla en caso de regurgitación, de otra manera permanecerá inflado para fijación. Si después de estas pruebas aún no se consigue ventilación pulmonar adecuada, el balón faríngeo se infla con 50 ml adicionales de aire y se intenta nuevamente por el tubo proxima. Si aún no se logra, y según reportes, se recomienda retirar el tubo tres centímetros, pues es posible que el balón esté empujando la epiglotis, impidiendo así el paso del aire. Si después de estas maniobras, aún no hay éxito, se usará otro dispositivo. Varios autores han utilizado una pera de caucho para ubicar la posición del combitubo con la misma teoría con la que había sido usada para detectar la intubación esofágical. Si el combitubo esta en esófago, al conectar la pera comprimida a la luz esofágica (proximal), esta expandirá, pues hay contacto con aire de la tráquea a través de las perforaciones esofágicas. Al conectarse a la luz traqueal (distal), permanecerá colapsada pues su luz distal está en esófago donde hay presión negativa. Se ha demostrado en pacientes normales, que la posibilidad de error es cero, aunque se debe tener en cuenta que en individuos con obstrucción severa de la vía aérea o con obesidad mórbidase pueden tener falsos negativos (Combitubo en tráquea y la pera no expande). Teniendo en cuenta lo anterior, se ha diseñado un algoritmo para identificar la ubicación del combitubo.
3. USOS
1. Reanimación cardiopulmonar
Varios dispositivos han sido usados para facilitar el manejo de la vía aérea en reanimación, entre ellos la máscara laríngea, el tubo faringeo-traqueal y el combitubo son los más importantes. Las ventajas del combitubo sobre la primera son la protección frente al peligro de la regurgitación, aunque esto no ha sido probado en ningún trabajo, y la facilidad para su colocación con la cabeza en posición neutra.
El combitubo está indicado en reanimación cardiopulmonar siempre y cuando no sea posible intubación endotraqueal. Varios trabajos han demostrado que es un instrumento adecuado pues provee adecuada ventilación y oxigenación, con poco entrenamiento y pocos riesgos. Además se logra la permeabilización de la vía aérea más rápidamente que con la intubación traqueal lo que disminuye el tiempo de hipoxia. Sorprendentemente se ha encontrado que se logra mayor PaO 2 con este dispositivo, lo que se ha explicado por un fenómeno de auto-PEEP debido a que tiene mayor resistencia al paso del aire y por lo tanto se produce atrapamiento de este.
En varias situaciones particulares el combitubo es de gran importancia. Cuando el paciente que se intenta reanimar presenta una anatomía difícil, cuando la intubación se realiza en sitios con poco espacio (transporte aéreo, pacientes atrapados bajo escombros, etc.), cuando el paciente presenta sangrado masivo en vía aérea superior o regurgitación importante que impidan la visualización adecuada de las cuerdas y cuando se sospeche trauma cervical que impida la movilización del cuello.
El combitubo ha sido indicado como alternativa para el manejo de la vía aérea en reanimación cardipulmonar en las guías de la Sociedad Americana del Corazón". Recientemente, en una revisión de reanimación hecha por anestesiólogos de distintos grupos europeos, se ha incluido dentro del algoritmo para el manejo avanzado de la vía aérea y se recomienda que el uso de las técnicas avanzadas debe ser una decisión individual de acuerdo al entrenamiento y la experiencia de cada uno". En estudios se ha encontrado que su inserción por paramédicos es exitosa en un 70%.
2. Cirugía electiva
El combitubo ha sido utilizado para el manejo de la vía aérea en cirugía de rutina, especialmente si se prevee dificultad para la intubación o existe alguna contraindicación para ella. Su uso resulta adecuado en cantantes y actores pues su ubicación, en la mayoría de la veces esofágica, evita la posibilidad de lesionar las cuerdas vocales y en pacientes que sufren artritis reumatoidea con subluxación atlanto-axial por el riesgo de desplazamiento al realizar las maniobras de intubación. Se recomienda que, en cirugía electiva de pacientes sin signos predictores de vía aérea difícil, se realice no sólo indu¿ción sino relajación muscular para evitar que los reflejos impidan su inserción. Parece que esta no es necesaria si se usa propofol como inductor. Puede ser recomendable el uso de un antisialagogo como la atropina o el glicopirrolato para evitar las secreciones ya que no es posible su aspiración cuando provienen de la vía aérea y el combitubo está en esófago. La extubación del paciente se hará una vez haya recuperado los reflejos protectores. No se ha documentado la presencia de estrés significativo al realizarla. Hasta ahora no hay reportes de uso del combitubo más allá de ocho horas.
3. Vía aérea difícil
El manejo de vía aérea difícil es una de las situaciones más complicadas que enfrenta el anestesiólogo. La incapacidad para permeabilizar la vía aérea es responsable del 30% de las muertes atribuibles totalmente a anestesia . El combitubo ha surgido como una opción importante en dicha situación fundamentalmente cuando el paciente no se puede intubar ni ventilar. La Sociedad Americana de Anestesia lo incluye en el algoritmo para el manejo de la vía aérea difícil. El combitubo ha sido usado en el manejo de pacientes obstétricos en casos de intubación fallida. Se debe tener en cuenta que el combitubo es dispositivo supraglótico y que no sirve en las situaciones en que se presenta obstrucción glótica y subglótica (laringospasmo, edema masivo, tumores, abscesos, etc.) y por lo tanto en estos casos se debe recurrir a otra técnica.
4. U.C.I.
Cuando se presenta alguna situación de emergencia que amerite permeabilización rápida de la vía aérea, la intubación traqueal puede ser difícil por toda la monitoría que presentan estos pacientes o la ubicación de la cama que no permite una adecuada ubicación del operador. El combitubo en esta situación se convierte en una alternativa útil. Las enfermeras de UCI han tenido la misma rata de éxito en su inserción que el personal médico. Los estudios han demostrado que el combitubo es eficaz como elemento de manejo de la vía aérea durante ventilación mecánica en pacientes de unidad de cuidados intensivos por 2 a 8 horas. Cuando se estabilice el paciente y se piense que es posible someterlo al cambio de tubo sin descompensarlo, se desinflará el balón orofaríngeo, y sin sacarlo se intentará la intubación endotraqueal, si no se logra, se desinfla el balón distal para evitar la desviación de la tráquea, si es exitoso se retira el combitubo. En esta maniobra puede ser de utilidad del fibrobroncoscopio (FOB) para visualizar seguramente la tráquea. Si a pesar de lo anterior no se consigue la intubación endotraqueal, se continúa la ventilación a través del combitubo. En pacientes de UCI seleccionados, es posible mantener una adecuada ventilación con el combitubo durante la realización de una traqueostomía percutánea por dilatación. Las ventajas de esta técnica radican en evitar la necesidad de laringoscopia, la tráquea está libre de obstrucción, es más fácil la manipulación y se disminuye la posibilidad de pérdida de la vía aérea. Se debe tener en cuenta que el balón esofágico produce un leve desplazamiento lateral de la tráquea.
5. Otros usos
Existen varios reportes en la literatura del uso del combitubo en trauma maxilofacial, especialmente en el evento agudo en que el paciente presenta dificultad para ser intubado y ventilado, si se logra ventilar adecuadamente es posible evitar el acceso quirúrgico de la vía aérea pues una vez permeabilizada y asegurada se puede realizar intubación endotraqueal si esta es imprescindible de la manera relatada anteriormente. Podrían surgir inconvenientes cuando existen heridas de la faringe o la posibilidad de crear falsas rutas o por la dificultad para la aspiración de sangre o secreciones. Faltan estudios con series grandes de pacientes para que sea aceptado como elemento para el manejo de la vía aérea en esta situación. Recientemente se ha publicado un artículo en el que se sugiere hacer una modificación uniendo varios de los orificios faríngeos para hacer uno mayor, a través del cual se podría pasar un fibrobroncoscopio, haciendo posible la intubación endotraqueal con una guía de alambre.
5.DESVENTAJAS
La gran desventaja del combitubo es la imposibilidad de la aspiración de las secreciones traqueales cuando queda en posición esofágica . Sin embargo, con la innovación de los orificios faríngeos se podría evitar dicho inconveniente pues a través del orificio resultante es posible pasar una sonda de 12. Solo viene en dos tamaños, por lo que se limita a adultos por encima de una estatura (ver contraindicaciones).
6. CONTRAINDICACIONES
Las siguientes son contraindicaciones para el uso del combitubo:
· Pacientes con reflejo nauseoso intacto, independiente del nivel de conciencia.
· Pacientes con menos de 152 cm. para el 41 y menos de 122 para el 37.
· Obstrucción central de la vía aérea.
· Ingestión de sustancias caústicas.
· Patología esofágica conocida o sospechosa.
7. COMPLICACIONES
La incidencia exacta de complicaciones es desconocida. Existen reportes de la presencia de laceraciones esofágicas que pueden llevar a enfisema subcutáneo en cara y cuello o incluso neumomediastino. Se plantea que el balón orofaríngeo puede producir alteración del flujo sanguíneo con el riesgo de edema y cianosis de la lengua. Se han reportado casos de ruptura esofágíca, aunque a diferencia del obturador esofágico el riesgo es pequeño.
8. CONCLUSIONES
El combitubo es un nuevo dispositivo para el manejo de la vía aérea que se ha ganado un lugar en reanimación cardiopulmonar y el manejo de la vía aérea difícil, fundamentalmente en casos de no intubación - no ventilación. Se ha usado en otras situaciones como trauma maxilofacial, unidad de cuidados intensivos y durante cirugía electiva; sin embargo, se necesitan estudios prospectivos con número importante de pacientes para consolidar sus indicaciones. Se han reportado varias complicaciones pero hasta ahora la incidencia real de estas es desconocida.
Autores:
Nelson Javier Fonseca Ruiz
Elmer Gaviria Rivera
Fuente: Sociedad Colombiana de Anestesiología
http://www.scare.org.co/
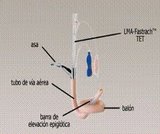
Máscara laríngea Fastrach (ILMA)
La máscara laríngea fastrach (ILMA) es una tubo rígido anatómicamente curvado lo suficientemente ancho para aceptar tubos endotraqueales esta unida a una asa de metal rígida que facilita la inserción, remoción y ajuste de la posición con una sola mano, este modelo avanzado de mascará laringea, creado por Archie Brain esta indicado en el manejo de la vía área difícil. En un estudio preliminar realizado por Brain que de 150 pacientes se logro intubar con la ILMA a 149 (99.3%) sin necesidad de utilizar el laringoscopio, sin embargo solo el 50% se logro intubar en el primer intento. El grupo de Singapur ha demostrado recientemente que se logro la intubación con la ILMA en el 97% de los pacientes; y también en este caso sólo el 50% se realizó al primer intento.
Graf. 1. Mascara Laringea Fast-Trach


Graf. 2. Números 3, 4 y 5 de ILMA
Sin embargo, la intubación endotraqueal usando la ILMA es todavía un procedimiento a ciegas y tiene un alto número de intubaciones fallidas en el primer intento. No es todavía un método seguro en los anestesistas que no tienen experiencia en el manejo de la mascara laringea. En una serie de artículos publicados, la inserción del tubo Brain a ciegas se logra en un 85% aproximadamente. Existen reportes que el periodo de aprendizaje mínimo del la técnica de colocación del ILMA es de 20 veces para poder resolver cualquier intubación difícil. Cuando existe una epiglotis desplazada hacia abajo se asocia a una mayor incapacidad de introducir el tubo, se recomienda levantar 6 cm. La mascara desinsuflada y bajar posteriormente para intentar otra vez la reintroducción “maniobra up-dowm.” Existen estudios que cuando la laringe es baja y posterior (Cormack I) es difícil de ventilar con la mascara y colocar el tubo Brain a diferencia si la laringe es alta y anterior donde la ILMA facilita la ventilación y la colocación del tubo, por eso es recomendable en el manejo de la Vía aérea difícil. Para evitar la intubación esofágica (8%) se recomienda una presión de la mascara sobre la glotis al desplazar ligeramente hacia atrás la mascara con la mano no dominante. La intubación visualizando la traquea a través de la mascarilla laríngea es potencialmente más rápida, confortable y segura que el avance a ciegas. Se recomienda un fibroscopio flexible preferentemente de 36.5 cm. de longitud.
La Clasificación de Brimacombe de la visualización de la glotis a través de la ILMA son:
Grado 4. Cuerdas vocales.
Grado 3. Cuerdas vocales y epiglotis posterior.
Grado 2: Cuerdas Vocales y Epiglotis anterior y
Grado 1. No se observan las Cuerdas vocales.
El éxito de la Intubación con la ILMA y Fibroscopia es de 99% - 100% de los casos. Cuando hay alteraciones anatómicas como tumoraciones cervicales que producen un desplazamiento de la laringe, el riesgo de la fragmentaciones del tumor y aspiración es mayor con la inserción a ciegas del ILMA.. Se recomienda en estos casos el uso del fibroscopio. Asi mismo en la actualidad algunos centros hospitalarios realizan la broncoscopía a través de la mascara laringea representando un avance de grandes proporciones al evitar en la gran mayoría de los casos desaturaciones dramáticas en estos procedimientos. Bandla y colab. describió la efectividad de la mascara laringea para la broncofibroscopia y lavado bronco alveolar en 19 lactantes bajo anestesia general y tópica, se utilizaron la mascara N1 y 2 a través de las cuales se introdujo un broncofibroscopio de 3,5 mm. Durante este procedimiento solamente un paciente requirió la intubación endotarqueal por la dificultad de ventilarlo con la mascara laringea. Un estudio realizado por Álvarez demostró el éxito de la ILMA en 60 pacientes adultos sometidos a broncofibroscopia, se logro la intubación en el primer intento en el 82%. La colocación del tubo endotarqueal a través de la guía transluminosa a través de la ILMA se denomina TRACHLIGT. En un estudio de 152 pacientes se logro la intubación a ciegas con la ILMA en un 73% y con la guía luminosa en un 96%. Dimitri y Voyeguis. Por la facilidad de colocar la ILMA en cualquier posición sin movilizar la columna cervical se ha indicado la utilización en pacientes con traumatismo vertebro medular. Asi en un estudio describe que una columna cervical alineada, la colocación de la ILMA es mas fácil y rápida que con el tubo endotraqueal. Aunque algunos reportes sugieren que la presión de la ILMA en la hipofaringe puede producir daños en pacientes con lesión o fractura cervical. No se recomienda para la intubación a través de la mascarilla laríngea el uso de tubos endotraqueales curvos de plástico standard, ya que se asocia con altas probabilidades de producir traumatismo laríngeo. En conclusiones existe una alternativa en el manejo de la vía aérea difícil, el éxito de la Intubación con la ILMA en pacientes con Vía aérea difícil es del 99% - 100% con Fibroscopia 95% con técnicas de transiluminacion y 85% a ciegas.
Link al artículo
Autor: Dr. Willy Orcada Garcia
Anestesiólogo del “Servicio Cirugía de Dia” Hospital Guillermo Almanara I. Lima
Fuente: http://www.monografias.com
13 noviembre 2006
Instrumentos de laringoscopia
Estómago lleno: ¿Un peligro cierto para la clínica anestésica?
La aspiración pulmonar del contenido gástrico es una de las complicaciones más temidas en la clínica anestésica, que implica alto riesgo de la vida para el paciente y es considerada como una catástrofe. El interés por el tema nace con la historia misma de la anestesiología; la primera muerte de causa anestésica, se debió a la aspiración de aguardiente, y no al cloroformo como se creyó en un primer momento, según el propio James Simpson, al analizar el caso en forma más detenida. La historia actual del manejo anestésico del paciente con estómago lleno comienza sin embargo en 1946, con la publicación del clásico trabajo de Mendelson en el American Journal of Obstetric and Gynecology. Este estudio describe el cuadro clínico producido por la aspiración de contenido gástrico en 66 pacientes en trabajo de parto sometidas a anestesia general, y hace un modelo experimental en conejos diferenciando la aspiración de material ácido y no ácido y demostrando la utilidad de la neutralización del Ph gástrico. En realidad, la Neumonitis Aspirativa, llamada desde entonces Síndrome de Mendelson, que ocurre por aspiración de contenido ácido, no corresponde al cuadro descripto por Mendelson, cuyas pacientes probablemente aspiraron sólo pequeñas cantidades de contenido ácido o sencillamente contenido no ácido. El contenido gástrico puede pasar al esófago y la faringe por dos procesos:
• Vómitos, consisten en la expulsión forzada de contenido gástrico a la faringe, requieren relajación de los esfínteres esofágico inferior y superior y actividad del músculo esquelético.
• Regurgitación, expulsión pasiva del contenido gástrico a la faringe, requiere relajación de los esfínteres esofágico inferior y superior, sin actividad del músculo esquelético.
¿Qué se entiende por estómago lleno? Cuando hablamos de estómago lleno podemos definirlo como el volumen mínimo contenido en el estómago que pone al paciente anestésico en riesgo de aspiración pulmonar de contenido gástrico. En 1994 Roberts y cols, determinaron en forma arbitraria que un volumen gástrico de 0,4 ml/k era indicativo de un incremento cierto de riesgo de aspiración pulmonar, esto fue establecido en monos, con escaso número y sin comprobación cierta posterior en humanos, por lo que luego de más de 30 años es necesario cuestionar esto y analizar si aportó seguridad, como resultado de este cuestionamiento se debe decir que:
• No existen evidencias en otros trabajos de investigación que avalen el enunciado de Roberts y cols.
• Se ha comprobado que en el momento de la inducción de anestesia en personas que han de ser sometidas a procedimientos electivos, el volumen del contenido gástrico se extiende entre 0,3 ml/k y 4,5 ml/k, si se aplicaran los criterios de Roberts entre 30 % al 60 % de la población estarían en riesgo cierto de aspiración pulmonar.
Debido a la baja relación entre volumen gástrico de 0,4 ml/k y la ocurrencia de aspiración pulmonar en la clínica anestésica, se debe pensar que existen otros factores o mecanismos diferentes que influencian la ocurrencia de la afección.
Incidencia
Es interesante conocer si la aspiración pulmonar y la consecuente neumonitis por aspiración es un evento que constituye una complicación frecuente, para ello es interesante un trabajo de Warmer y cols quienes a fin de estudiar la asociación de aspiración pulmonar y aumento de morbimortalidad en la clínica anestésica, estudiaron retrospectivamente 172.334 pacientes que recibieron 215.488 anestesias generales en mayores de 18 años, abarcando todas las especialidades quirúrgicas (6 años de trabajo en anestesia de la Clínica Mayo), en este trabajo se establecieron los siguientes criterios como diagnóstico de aspiración pulmonar.
Criterios diagnósticos de aspiración pulmonar utilizados:
1.- Presencia de bilis o partículas alimenticias en el árbol traqueo bronquial.
2.- Presencia de infiltrado en Rx tórax posoperatoria que no se observaba en las anteriores.
3.- Aparición de tos o espasmos y secreciones en el pos operatorio.
Además con el fin de evaluar la gravedad de la afección se registró la aparición de:
1.- Tos, rales finos o espasmos bronquiales.
2.- Saturación Hb O2 90 % con una Fi O2 de 21%.
3.- Pa O2 300 mmHg con O2 100 % con paciente intubado.
4.- Anormalidades de Rx antes de dos horas de la aspiración.
Con el fin de poder señalar las condiciones clínicas asociadas a la aparición de aspiración pulmonar, se estudió: edad, sexo, afecciones concurrentes, metabólicas, cardiovasculares, renales, hepáticas, cardiorrespiratorias, estado físico ASA y el registro de condiciones específicas asociadas como: embarazo, falta de ayuno, opioides, obstrucción intestinal, hernia hiatal, obesidad, depresión de la conciencia, lesiones físicas, afecciones esofágicas, daño neurológico, pérdida de reflejo deglutorio, tipo de anestesia y momento del incidente. Como resultado del estudio de Warner y cols., 67 casos en 215.488 anestesias, la población de mayor riesgo son pacientes de estado Físico ASA III y ASA IV y los que son sometidos a anestesia general en emergencias y no se registró independencia de ninguno de los siguientes factores: edad, sexo, embarazo, falta de ayuno, opioides, obesidad, afecciones concurrentes, metabólicas, cardiovasculares, renales, hepáticas, cardiorrespiratorias, obstrucción intestinal, hernia hiatal, depresion de la conciencia, daño neurológico y pérdida de reflejo deglutorio. Pero 1 o más de éstos estuvieron presente en 24 de las 52 intervenciones electivas y en los 15 de los pacientes de emergencia. Es interesante destacar que 52 de las intervenciones en las que se produjo aspiración pulmonar de contenido gástrico, se trataban de intervenciones electivas que cumplían con las indicaciones de ayuno.
Las condiciones que más frecuentemente se asociaron a Aspiración Pulmonar fueron:
• Obstrucción intestinal (21).
• Pérdida de reflejo deglutorio (6).
• Depresión de la conciencia (6).
• Cirugía previa de esófago (3).
• Falta de ayuno (3).
Además, no se observó aspiración pulmonar en 256 cesáreas electivas en 389 cesáreas de urgencia. En relación al momento en el que ocurrió la aspiración se comprobó que ocurrió en la extracción del tubo 35,9 %, con la laringoscopía 32, 9%, después de 5 minutos de la extubación 10% y el resto fue durante la inducción antes de la laringoscopía sin ventilación 5% y con ventilación 5%. Llama la atención la alta incidencia de aspiración pulmonar relacionada con la extubación cuando la mayoría de las medidas profilácticas que se indican están relacionadas con la laringoscopía y la intubación. Los hallazgos de este estudio nos lleva a realizarnos una interesante pregunta: A pesar de la baja incidencia y la baja morbimortalidad. ¿Debemos continuar en alarma de peligro sobre la aparición de aspiración pulmonar de contenido gástrico? La respuesta es: SI. Debemos continuar con las medidas profilácticas, debido a que la aplicación de las mismas es la responsable de una disminución a la mitad de eventos en los últimos 20 años. Por eso se expondrán las medidas clínicas y farmacológicas de que se dispone y la utilidad de las mismas.
Evaluación preoperatoria.
Una evaluación de la HC, el examen físico y un adecuado interrogatorio dirigidos a detectar:
Reflujo gastroesofagico.
Sintomas de disfagia.
Afecciones funcionales o anatomicas del esofago.
Alteraciones de la motilidad gastrointestinal.
Posible via aerea dificultosa.
Alteraciones metabolicas, (diabetes, hipotiroidismo)
Afecciones neurologicas.
Ayuno
El ayuno continua siendo una de las medidas fundamentales como profilaxis de la aspiracion pulmonar.

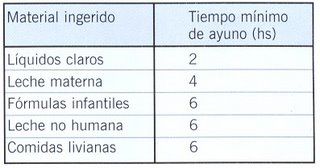
Sonda nasogastrica.
La sonda nasogástrica a pesar de ser aplicada con el fin de ser vaciado el estomago, tiene inconvenientes y restricciones en su utilización como son: La maniobra de colocación de la SNG es de por si un provocador de vómitos. Es efectiva solo para la evacuación de contenido liquido. no puede evacuar contenido particulado. Disminuye la eficacia del Esfinter Esofago Interior. Util para la administracion de antiacidos. Debe utilizarse con cuidado en pacientes con trauma.
Medidas farmacologicas.
Anticolinergicos.
La atropina, el glicopirrolato y otros farmacos similares, disminuyen la produccion de jugo gastrico pero no modifican el contenido. Su uso se contraindica por la disminucion del tono y la presion del Esfinter Esofago Inferior.
Antiacidos.
La disminucion del pH del contenido gastrico es acertado y aumenta el tono del Esfinter Esofago Inferior. Se recomienda no particulados: 30ml de citrato de Sodio 0,3molar. 2 comp. de Alka Seltser en 30ml de agua
Antiemeticos.
Drogas como droperidol y ondansetron reducen las nauseas y vomitos preoperatorios, pero no existen evidencias de que disminuyan la aspiracion pulmonar de contenido gastrico. No se recomienda su uso en forma rutinaria en pacientes con riesgo.
Estimulantes motilidad gastrointestinales.
Son eficaces en la reducción de contenido gástrico (Metoclorpropamida-Domperidona). No se ha demostrado que sean eficaces para modificar el retardo de la evacuación gástrica producida por drogas (opioides, anticolinergicos, etc.) Se recomienda su uso solo en pacientes con factores de riesgo para la aspiracion pulmonar.
Farmacos bloqueantes de la secrecion acida.
Los antagonistas de receptores H1 (ranitidina, cimetidina) e inhibidores de la bomba de protonoes (omeprazol, lanzoprazol) son eficaces en la reduccion de volumen y pH de la secrecion gastrica. Los inhibidores de la bomba de protones interfieren la cP450 y el metabolismo de algunos anestesicos. No se recomienda su utilizacion. No se demostro relacion alguna entre su utilizacion y la mejora en la ocurrencia de aspiracion pulmonar y la morbimortalidad. Todos son igualmente eficaces a la ranitidina.
Induccion de Secuencia Rapida.
Esta maniobra clinica es una de las mejores a aplicar como profilaxis de la aspiracion pulmonar durante la induccion y esta indicada en todos los pacientes con peligro de neumonitis por aspiracion, incluidos los que no han ingerido alimentos recientemente.
Tecnica y equipamiento.
Aspiracion Laringoscopios con palas diversas.
Tubos endotraqueales de diferentes medidas.
Ayudante con entrenamiento previo.
Tecnica preoxigenacion.
Administrar oxigeno 100% durante 3 a 5 minutos.
Tecnica induccion.
Agente intravenosos rapidos (tiopental, propofol, ketamina) relajantes rapidos succinilcolina. Maniobra de Sellick.
Presion Cricoidea (Sellick).
Posicion: debe abandonarse la posicion indicada originalmente por Sellick, que era la de amigdalectomia, cambiando por la posicion de intubacion normal de Maguill. Momento de la presion: La presion debe comenzarse en el momento de la perdida de la conciencia, no realizar la presion con el paciente despierto debido a que dificulta la respiracion y genera vomitos y nauseas. Fuerza de la presion: Aplicar una presion de hasta 3kg. (30N) utilizando el dedo indice y pulgar, previniendo desplazamiento lateral de la laringe.
Autor: Dr. Gustavo Adolfo Elena
http://www.ararosario.com.ar
12 noviembre 2006
Uso de la Ketamina en Cirugía Ambulatoria
Recientemente se ha publicado que la aplicación de pequeñas dosis de Ketamina, 75 a 100 mcg/kg IV junto con morfina a dosis de 50 mcg/kg IV, reduce los requerimientos de morfina en el postoperatorio tras CA, aproximadamente en un 50 %, durante la primera fase de recuperación. La administración de ketamina y morfina permite la administración de dosis inferiores de cada una de ellas, disminuyendo los efectos secundarios propios de estos fármacos. Teniendo en cuenta que estos pacientes van a ir a sus domicilios en poco tiempo, este estudio es importante, al demostrar que no se afecta de manera significativa la capacidad sensorial, probablemente debido a las bajas dosis empleadas. Ningún paciente se sintió disfórico, y todos expresaron sentirse relajados y confortables. Otra línea de estudio, en cirugías de alto impacto nociceptivo intraoperatorio, propone la utilización de dosis de carga de Ketamina a razón de 0,3 mg/kg de peso, seguida de una infusión basal continua a una tasa de infusión de entre 0,1 y 0,2 mg/kg/hora. En estos casos, es conveniente el retiro paulatino de dicha infusión antes del despertar, para poder disminuir la posibilidad de deterioro cognitivo postoperatorio.
Concepto de confort en el postoperatorio
Aunque evitar el dolor es un objetivo muy importante, desde el punto de vista del paciente, lo principal no es la analgesia, sino el confort global, la ausencia de complicaciones y la seguridad en el postoperatorio. El concepto de confort, del cual forma parte fundamental la analgesia, también está formado por la rápida recuperación de la ingesta y del tránsito intestinal, por la ausencia de náuseas y vómitos, la conservación o restauración completa del estado de conciencia y alerta, la deambulación precoz, y también la ausencia de ansiedad y estrés, motivados por la operación o por la recuperación futura de la misma. La primer noche tras una intervención quirúrgica, se debe administrar una dosis oral del analgésico, suficientemente alta y lo más tarde posible, para que cubra toda la noche, o proveer al paciente con algún sistema automático de administración, que permita mantener la concentración plasmática del analgésico durante ese período de tiempo. Una de las fuentes que origina DP, procede del espasmo de la musculatura visceral en cirugías abdomino-pélvicas. En estos casos, el uso de Dipirona a dosis de hasta 50 mg/kg por única vez (“Shock de Dipirona”) o Glicopirrolato a dosis de 0,3 mg, reduce de inmediato el DP y el consumo de opioides durante el período postoperatorio.
Alejandro G. Haidbauer
Director del Curso Universitario de Postgrado “Clínica del Dolor Agudo”. UBA – AAARBA
Sub-Director del Departamento de Docencia e Investigación. Fundación Dolor - AAARBA
Fuente: http://www.ararosario.com.ar
Tratamiento del dolor postoperatorio: sus complicaciones
Complicaciones del tratamiento
1. Complicaciones de la analgesia local y regional
2. Complicaciones de la administración medular de opiáceos
3. Otras complicaciones
Complicaciones de la analgesia local y regional
Tras la aplicación de anestesia regional podemos encontrarnos con reacciones tóxicas a nivel sistémico debido a diferentes causas: una dosis excesiva, la inyección intravenosa accidentalmente de dosis terapéuticas, o bien por tasas anormales de absorción y biotransformación. Los síntomas que puede presentar el paciente van desde palpitaciones, gusto metálico en la boca, tinnitus y vértigo, hasta convulsiones, hipotensión, bradicardia y depresión respiratoria. Otras complicaciones de la anestesia regional incluyen las reacciones psicógenas, en las que influye el tipo de personalidad del paciente y estado ansioso; las reacciones alérgicas, con la presencia de urticaria, edemas en las articulaciones e incluso edema laríngeo con el riesgo que ello comporta. La interrupción de las vías nociceptivas del dolor constituyen la base de las técnicas de anestesia local. Cada una de las técnicas presenta unas complicaciones que deben valorarse a la hora de la indicación de una técnica u otra y de su realización. Las complicaciones del bloqueo paravertebral de los nervios cervicales, incluyen la inyección accidental en el espacio subarcnoideo, con la consiguiente anestesia espinal total, o la inyección en la arteria vertebral, produciendo convulsiones y la pérdida de conciencia. Otras complicaciones de esta técnica pueden ser el bloqueo concomitante de la cadena simpática con el desarrollo de un síndrome de Horner, o la afectación del nervio laríngeo superior o incluso el tronco del nervio vago. La complicación más seria del bloqueo supraclavicular del plexo braquial es el neumotórax, con una incidencia del 0,5 al 6% de los bloqueos. Otras complicaciones que se producen al utilizar grandes volúmenes de drogas son el bloqueo ipsilateral del nervio frénico, que puede causar sintomatología en aquellos pacientes con enfermedad crónica pulmonar severa y el síndrome de Horner. Por vía interescalénica es más frecuente la afectación del nervio frénico. Cuando se realiza un bloqueo axilar las posibles complicaciones incluyen la inyección intravenosa con reacción sistémica, el hematoma o la lesión del nervio. Las técnicas de bloqueo continuo del plexo braquial se asocian a un mayor riesgo de infección y de parestesias persistentes (más de 3 meses) con una incidencia de 1/5000 (102). En el bloqueo intercostal la complicación más importante es el neumotórax, con una incidencia inferior al 1%. También es importante el riesgo de toxicidad local debida a la gran vascularización del espacio intercostal que favorece una mayor absorción del fármaco. Las técnicas con catéteres interpleurales presentan una incidencia de neumotórax del 2%, con la posibilidad de toxicidad local, infección y síndrome de Horner.
Complicaciones de la administración medular de opiáceos
La administración perimedular de opiáceos es una técnica eficaz, segura y con una baja incidencia de efectos adversos. Las náuseas, vómitos, prurito y retención urinaria son los más frecuentes aunque el más importante, y el que debe ser merecedor de nuestra mayor atención es la depresión respiratoria t a r d í a . Puede aparecer una depresión respiratoria temprana secundaria a la absorción vascular del opiáceo, y una depresión tardía secundaria a la migración cefálica. La depresión respiratoria tardía puede ocurrir hasta 18 horas después de la administración. La incidencia de depresión respiratoria se ve influenciada por factores como la dosis, edad, postura, hidrosolubilidad del opiáceo, ventilación con presión positiva y aumento de la presión intraabdominal. El riesgo de depresión respiratoria aumenta cuando al paciente que recibe opiáceos por vía espinal, se le administran otros opiáceos por otras vías imultáneamente. En un estudio prospectivo sobre 1.062 pacientes realizado por Burstal y cols., la incidencia de depresión respiratoria fue del 0,24% y no hubo ningún caso de depresión respiratoria tardía. Al utilizar esta técnica es necesario un buen control de estos pacientes en el área de reanimación, con una adecuada monitorización y atendidos por personal cualificado. La aparición de náuseas y vómitos varía entre el 15 y el 50%. Pueden aparecer náuseas y vómitos incipientes, tras la administración epidural de morfina como consecuencia de la captación sistémica, y puede verse 6 horas después de la administración intratecal, de forma secundaria a la difusión rostral hasta la zona quimiorreceptora gatillo y el centro del vómito. Los agentes liposolubles pueden presentar una menor incidencia de esta complicación. El prurito aparece en un 8,5% de los pacientes que reciben opiáceos por vía epidural y en un 46% cuando es por vía intradural. El prurito difunde habitualmente de forma segmentaria y es frecuente su aparición en la cabeza y el cuello tras la afectación rostral del núcleo del trigémino. La retención urinaria aparece entre el 15 y el 42% de los pacientes postoperados que reciben opiáceos por vía medular y no se ha demostrado que esté en relación con la dosis administrada. Los agentes liposolubles pueden presentar una menor incidencia de retención urinaria. Además de estas complicaciones que son las más frecuentes, hay que tener en cuenta las inherentes a la realización de la técnica y sus implicaciones neurológicas. Es bien sabido que el uso de anestesia local epidural tras la cirugía, retrasa el diagnóstico de déficits neurológicos en el postperatorio y esto puede ser fatal para el paciente enmascarando complicaciones tan graves como una isquemia de la arterial espinal anterior. En cirugías en las que hubiera una mayor probabilidad de este síndrome y fuera necesaria la técnica epidural, se aconseja la utilización de opiáceos en lugar de anestésicos locales que nos pudieran enmascar el cuadro. También se han descrito cuatro veces más complicaciones neurológicas con el uso de anestésicos locales por vía epidural en cirugía traumatológica para la reconstrucción de fracturas tibiales, que con el uso de narcóticos por vía sistémica. Otros cuadros neurológicos como el síndrome de Horner y el de Pourfour du Petit se han descrito al utilizar técnicas de anestesia regional , y no únicamente con técnicas de anestesia peridurales, sino también con anestesia intraoral, bloqueos del plexo braquial y analgesia intrapleural. El síndrome de Claude Bernard-Horner se produce por parálisis de la cadena simpática cervical ipsilateral y su duración es transitoria regresando en los 3 meses siguientes a la lesión, sin embargo hay que tener en cuenta que el síndrome de Horner puede preceder a un bloqueo espinal alto y el consiguiente colapso c a r d i o v a s c u l a r. El síndrome de Pourfour du Petit es el síndrome opuesto al Horner y es causado por una estimulación de la cadena simpática cervical ipsilateral. Puede preceder a un síndrome de Horner. La complicación hemorrágica más grave asociada a la técnica epidural es el sangrado. La gravedad se explica por producirse el sangrado en una cavidad poco distensible produciendo una compresión e isquemia medular. El pronóstico neurológico depende de la rapidez del diagnóstico y tratamiento. La etiología es multifactorial, más frecuentemente asociado a trastornos de coagulación y punciones traumáticas. La incidencia de lesión de los vasos epidurales se sitúa entre el 2 y el 22%. Para prevenir esta seria complicación se aconseja realizar la técnica de 10 a 12 horas depués de la última dosis de heparina de bajo peso molecular. El tratamiento, en la mayoría de los casos, requiere cirugía descompresiva. En relación a las complicaciones infecciosas una complicación con graves repercusiones es la posibilidad de desarrollo de abscesos epidurales. El síntoma inicial suele ser un dolor intenso en la espalda y puede aparecer hasta 20 días después de la retirada del catéter. La sospecha debe ser precoz ante la posibilidad de compresión medular y paraplejia.
Otras complicaciones
Con la adquisición de nuevas técnicas en la administración de analgésicos aparecen nuevas complicaciones. Es el caso de la PCA. La participación de los pacientes en el tratamiento de su dolor alivia su ansiedad y permite que el paciente administre y mantenga los niveles terapéuticos de los agentes analgésicos necesarios para sus necesidades particulares. El propio paciente controla de una manera eficaz las posibles variaciones en las respuestas farmacocinéticas y farmacodinámicas que no pueden ser cubiertas por la analgesia convencional a dosis fija e intervalos c o n t r o l a d o s . En cuanto a las complicaciones en el funcionamiento del aparato de PCA, éstas pueden deberse a múltiples causas. Sin embargo , son complicaciones fácilmente evitables con el uso de protocolos adecuados y personal adiestrado ensu funcionamiento constituyendo un instrumento fundamental en el tratamiento del dolor postoperatorio .
Para leer el artículo completo clikear aquí.
Autores
F. Muñoz-Blanco*, J. Salmerón**, J. Santiago** y C. Marcote***
*Jefe de Servicio **Médico Residente 4º año ***Jefe de Sección Servicio de Anestesiología, Reanimación y Tratamiento del Dolor
Hospital Torrecárdenas. Almería
Fuente
http://revista.sedolor.es/
Tratamiento del dolor postoperatorio: farmacología
Es indudable el beneficio que se obtiene con el tratamiento del dolor postoperatorio. Se afirma que con la apropiada prevención y el adecuado tratamiento de los síntomas postoperatorios, se podría disminuir en un 9,6% la duración media de la estancia postoperatoria tras la anestesia general. Las distintas modalidades de tratamiento farmacológico del dolor postoperatorio actualmente disponibles incluyen analgésicos por vía intramuscular, subcutánea, intravenosa, oral, rectal y transdérmica, perfusión continua y administración controlada por el paciente de opioides y/o AINEs, y bolos intermitentes y/o perfusión continua de opioides intratecal e s . A los métodos farmacológicos hay que añadir una serie de terapias alternativas que, con mayor o menor éxito, se están utilizando: la estimulación eléctrica transcutánea o TENS, el bloqueo nervioso por congelación o crioanalgesia y los métodos psicológicos. La distinta naturaleza de los fármacos empleados, la vía y la técnica de administración, y la edad y estado general del paciente, nos van a condicionar el resultado analgésico y los problemas relacionados con dicho tratamiento. El objetivo consiste en mantener un nivel terapéutico (analgésico) del fármaco, previniendo la aparición de picos agudos, dentro de niveles tóxicos, y la caída a concentraciones subterapéuticas. Una dosis en forma de bolo intravenoso permite un comienzo rápido de los efectos, concentraciones máximas en poco tiempo y una reducción relativamente rápida del efecto del fármaco con disminución rápida de su concentración, minimizando el periodo en el que el nivel del fármaco se mantiene dentro del rango tóxico. La administración repetida de dosis terapéuticas a intervalos iguales a la vida media eliminará las fluctuaciones observadas con el uso de bolos y permitirá que el nivel sanguíneo se mantenga durante más tiempo dentro del rango terapéutico. Las fluctuaciones mayores se dan con las inyecciones intravenosas repetidas y serán menores con la administración oral. Estas fluctuaciones se pueden evitar mediante una infusión continua. El bolo inicial puede lograr un nivel terapéutico de inmediato, evitando un retraso en el establecimiento del efecto, y mantenerlo mediante la infusión continua del fármaco . Para conseguir un manejo analgésico adecuado hay que tener en cuenta ciertas normas.
AINEs
La aspirina, el paracetamol y el resto de los A I N E s como el ibuprofeno, naproxeno, diclofenaco, piroxicam, ketorolaco, indometacina y metamizol son los analgésicos más comúnmente usados en todo el mundo. Constituyen el tratamiento principal para el dolor leve y moderado. Los AINEs han demostrado ser eficaces
en las toracotomías, cirugía mayor ortopédica, cirugía abdominal y cirugía menor. Puede ser muy útil su utilización en combinación con los opiáceos debido a sus diferentes modos de acción , pudiendo reducir los requerimientos de morfina un 49% en pacientes de cirugía abdominal tras la administración de ketorolaco. Los beneficios de la combinación de AINEs con opioides en el período postoperatorio inmediato no sólo incluyen una mejoría en la analgesia sino también las asociados a la utilización de una menor dosis de opiáceos con la consiguiente mejoría en la función respiratoria, la disminución de náuseas y vómitos y una menor sedación. El tratamiento con AINEs presenta las siguientes contraindicaciones relativas: historia de úlcera péptica, existencia de sangrado gastrointestinal o alteración hematológica, operaciones asociadas a gran pérdida de sangre, asma, moderada a severa afectación renal, deshidratación, o historia de hipersensibilidad a la aspirina o AINEs. Al dosificarlos hay que tener en cuenta que presentan techo analgésico, es decir, al sobrepasar una cierta dosis no conseguiremos aumentar la eficacia analgésica y en cambio aumentarán los efectos adversos. Tienen varias ventajas sobre los opioides, no tienen efectos hemodinámicos, no causan depresión respiratoria ni alteraciones en la motilidad gastrointestinal. Sin embargo, el coste de algunos de ellos es significativamente mayor que el de la morfina. Los AINEs están disponibles en una gran variedad de fórmulas: comprimidos, inyectables, cremas de uso tópico y supositorios. La incidencia de efectos secundarios y adversos no varía utilizando una vía u otra. La introducción de los AINEs por vía parenteral ha aumentado el número de pacientes que pueden beneficiarse de los fármacos no opioides. Los efectos secundarios de la aspirina incluyen náuseas, mareos o hemorragia gastrointestinal por sus efectos antiagregantes plaquetarios que son irreversibles. La aspirina tiene una asociación epidemiológica con el síndrome de Reye y no debería administrarse en niños menores de 12 años de edad. El paracetamol tiene propiedades analgésicas y antipiréticas pero sus efectos antiinflamatorios son escasos y no afecta a la agregación plaquetaria. Su absorción oral es buena y se metaboliza en el hígado pudiendo ser hepatotóxico en sobredosis. El propacetamol constituye la alternativa parenteral del fármaco .
Opioides
Dentro de los opiáceos tenemos dos grandes grupos: los opiáceos menores o débiles y los opiáceos mayores. La codeína y el dextropropoxifeno pertenecen al primer grupo y son normalmente utilizados en combinación con AINEs como el paracetamol o metamizol debido a su limitada acción analgésica. No ocurre así con el tramadol, otro opiáceo menor que se comporta como un analgésico central con escasa afinidad por los receptores opiáceos teniendo una potencia similar a la petidina pero sin causar depresión cardiovascular o respiratoria relevante. El tramadol se ha asociado con la existencia de recuerdo intraoperatorio y somnolencia y en el postoperatorio las náuseas y vómitos son las reacciones adversas más frecuentes relacionadas con su uso . Para el tratamiento del dolor severo con origen en las estructuras viscerales profundas necesitaremos el uso de opiáceos mayores tales como morfina, metadona, petidina/meperidina y buprenorfina. Estos analgésicos constituyen el pilar fundamental sobre el que se asienta el tratamiento del dolor postoperatorio. En general, la eficacia de los diferentes opiáceos para aliviar el dolor es bastante similar cuando se utilizan dosis equipotentes. Las reacciones adversas más frecuentes de los opiáceos son bien conocidas y es deber del anestesiólogo el saber detectarlas y tratarlas. La morfina es el opiáceo por excelencia y es el punto de referencia para el resto de opiáceos. Se absorbe por todas las vías a excepción de la transdérmica. La meperidina es un agonista sintético con propiedades anticolinérgicas. A diferencia de la morfina, deprime muy poco el reflejo tusígeno y la motilidad gastrointestinal y resulta eficaz para controlar los escalofríos postanestésicos. La buprenorfina es un agonista parcial mu. Hay que tener en cuenta que puede producir depresión respiratoria que, aunque limitada, no es antagonizable por la naloxona a diferencia de los otros opiáceos. Un compuesto sintético con una potencia 100 veces superior a la morfina, muy utilizado intraoperatoriamente, es el fentanilo. En la actualidad se utiliza para el control del d olor postoperatorio en perfusión continua o en PCA. A estos opiáceos se ha añadido muy recientemente el remifentanilo, disponible en España desde 1997. Se trata de un análogo del fentanilo con un comienzo de acción y metabolización muy rápido que hacen que sea un opiáceo muy seguro y de fácil control, circunstancias que hacen que se necesite analgesia suplementaria al cesar la perfusión. Son necesarios nuevos estudios para valorar su seguridad debido a sus propiedades farmacocinéticas y la descripción de protocolos adecuados para conseguir resultados aceptables en el tratamiento del dolor postoperatorio. La administración de opiáceos por vía oral no siempre es posible en el postoperatorio inmediato. Esta vía es mejor aceptada por el paciente, es barata y simple de administrar. La principal desventaja se debe a la reducción de la absorción debido al retraso del vaciamiento gástrico tras la cirugía. Además se reduce la biodisponibilidad debido al metabolismo de primer paso representado por el hígado. La vía sublingual ofrece algunas ventajas. La absorción se hace directamente en la circulación sistémica y se evita el metabolismo de primer paso. El opiáceo más comúnmente usado por esta vía es la buprenorfina con una absorción rápida y una duración larga (6 horas).
La vía rectal es útil cuando el paciente presenta náuseas y vómitos. Sin embargo, la absorción es errática. Las dosis por vía rectal para la mayoría de los opiáceos mayores es la mitad de la dosis oral. El sulfato de morfina y la meperidina son frecuentemente administradas por vía intramuscular. Las principales desventajas de esta vía son el dolor en la administración y la existencia de picos en los niveles plasmáticos. Las inyecciones subcutáneas pueden ser muy eficaces en el tratamiento del dolor. El comienzo de la mejoría es similar en el tiempo a la administración por vía intramuscular. Además, la inyección es menos dolorosa y el efecto es más duradero. La práctica más común siempre ha sido la administración de pequeñas dosis (bolos) de opiáceos de forma intravenosa. Este método tiene el inconveniente de producir fluctuaciones en las concentraciones plasmáticas del fármaco. La infusión intravenosa continua obvia este problema y hace que se constituya como una de las vías de administración más usadas en el dolor postoperatorio dado su rápido comienzo de acción. A estas vías tradicionales y bien conocidas en la experiencia diaria del anestesiólogo, se ha añadido un nuevo método que se ha demostrado eficaz al tener en cuenta la variabilidad existente en los requerimientos individuales de opioides, se trata de la analgesia controlada por el paciente o PCA. Este sistema permite al paciente recibir la droga a través de una bomba, generalmente por vía intravenosa, cuando él mismo presiona un botón. El anestesiólogo tiene la posibilidad de determinar la dosis que recibe el paciente cuando éste presiona el botón, la duración mínima de tiempo entre dosis consecutivas, cuanta droga puede ser inyectada en un tiempo limitado (1-4 horas), la dosis bolo disponible para ser administrada a través de la bomba por el personal calificado en un momento determinado, y el ritmo basal o perfusión continua, sin necesidad de ser controlada por el paciente. Se hace imprescindible una buena información al paciente para el buen funcionamiento de esta técnica. Normalmente el paciente hace un mayor uso de dosis en el postoperatorio inmediato y va decreciendo con el tiempo. La dosis total de opioides utilizada es menor cuando se usa PCA e n comparación con la vía intramuscular y hay una superior analgesia y menores efectos adversos en comparación con la administración en bolos. Palacio y cols., proponen esta técnica por sus beneficios en el control de la respuesta de estrés en el postoperatorio tras cirugía pediátrica. Los opiáceos por vía intratecal y epidural son usados en una gran variedad de procedimientos quirúrg icos y consiguen una mejora del dolor postoperatorio. La técnica anestésica por vía epidural proporciona una excelente mejora y un alto grado de satisfacción para el paciente incluso cuando se compara con el patrón oro de la terapia del dolor agudo (PCA intravenosa con opiáceos). Es una técnica indicada en los casos de dolor postoperatorio significativo, especialmente en casos de movilización dolorosa, pacientes con factores de riesgo pulmonar (ASA III o IV), cuando es necesaria una mejora de la perfusión y/o motilidad gastrointestinal; y para la prevención del síndrome de dolor crónico como la amputación de una extremidad. Existe una variación en el comienzo de acción de la analgesia dependiendo de la naturaleza lipofílica o hidrofílica del opiáceo. La morfina, que es hidrofílica, alcanza el efecto máximo de analgesia a los 45 minutos de su administración por vía espinal y dura entre 8 y 12 horas. La petidina, metadona y fentanilo, siendo lipofílicos, actúan más rápidamente pero su duración es más corta. En un estudio comparativo entre el fentanilo y la metadona por vía epidural realizado por Prieto, se comprobó que ambos eran eficaces en el tratamiento del dolor postoperatorio pero el fentanilo se asociaba con una menor incidencia de hipoxemia que la metadona. El fentanilo por su bajo peso molecular, alta potencia y liposolubilidad se ha usado por vía transdérmica en forma de parches que liberan una dosis constante de 25 a 100 microgramos a la hora. Sin embargo, su indicación principal es para el tratamiento del dolor crónico. En el dolor postoperatorio estaría contraindicado por el riesgo de complicaciones respiratorias. Son necesarios más estudios sobre la viabilidad de esta forma de administración en el dolor postoperatorio. Otra vía de administración en estudio es la intranasal; Striebel y cols. demuestran que es tan eficaz como la intravenosa en pautas de tratamiento controladas por el paciente.
Anestésicos locales
El bloqueo reversible de la conducción nerviosa a través de la inyección directa de anestésicos locales, proporciona una analgesia efectiva y segura especialmente en ciertas intervenciones como son las de cirugía abdominal, las ortopédicas y torácicas. La prilocaína, lidocaína y mepivacaína constituyen los principales anestésicos locales de vida media (1-3 horas), mientras que la tetracaína, bupivacaína y recientemente la ropivacaína, un enantiómero de la bupivacaína con menor toxicidad cardiovascular y neurológica que ésta, pertenecen a los anestésicos locales de vida larga . Estos fármacos, utilizados en técnicas concretas como el bloqueo intercostal, la analgesia interpleural, los bloqueos "3 en 1" de la extremidad inferior y el bloqueo del nervio dorsal del pene tras la circuncisión, han demostrado su eficacia en el manejo del dolor postoperatorio.
Otros fármacos
Existen otros fármacos que se utilizan en el tratamiento del dolor postoperatorio como por ejemplo el óxido nitroso, la calcitonina, la ketamina, la somatostatina, la clonidina y la guanfacina.Recientemente se estudian los efectos del sulfato de magnesio que actuaría como antagonista del receptor NMDA, como la ketamina, y los antagonistas del receptor de la sustancia P, involucrada en la transmisión del dolor. Son fármacos con resultados esperanzadores aunque hacen falta más estudios para poderlos incluir de manera sistemática en esta parcela del dolor.
Para leer el artículo completo clikear aquí.
Autores
F. Muñoz-Blanco*, J. Salmerón**, J. Santiago** y C. Marcote***
*Jefe de Servicio **Médico Residente 4º año ***Jefe de Sección Servicio de Anestesiología, Reanimación y Tratamiento del Dolor
Hospital Torrecárdenas. Almería
Fuente
http://revista.sedolor.es/